Кактусы как вредные и лечебные растения. (часть 2)
Доктор Hans Swart
Специалист по химической токсикологии. Академия наук ГДР.
Гликозиды как действующие вещества.
Dominguez и его коллеги сообщают в 1969 году о результатах биохимического исследования многочисленных мексиканских шарообразных и колонновидных кактусов. После этого в них были найдены, кроме алкалоидов, также и дубильные вещества, 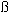 -ситостерин, флавонол-гликозиды, воздействующие на сердце гликозиды и сапонины. -ситостерин, флавонол-гликозиды, воздействующие на сердце гликозиды и сапонины.
В качестве гликозидов обозначают природные вещества, у которых молекула углевода связана с неуглеводной составной частью, т. н. аглюконом или генином. Хотя в деталях еще полностью не ясно фармацевтическое воздействие некоторых кактусов, но наряду с алкалоидами, оно также может быть основанным на сапонинах и других гликозидах. Сапонины во многих семействах растений являются природными веществами, в водном растворе они подобно мылу при встряхивании образуют пену и имеют поверхностно-активное действие (Sapo (лат.) - мыло). Попадая непосредственно в кровь, они разрушают мембраны красных кровяных клеток и оказывают гемолитическое действие. Но при оральном приеме их токсичность для
теплокровных животных незначительна, так как они плохо всасываются в желудочно-кишечном тракте. При высоких дозах сапонины раздражают слизистую оболочку рта и вызывают желудочно-кишечное воспаление, сопровождаемое рвотой и поносом, а также кожное
раздражение, и при неоднократном контакте образование экзем. Терапевтически используются различные сапонины из других семейств растений как муколитическое (отхаркивающее), противовоспалительное, антибиотическое, мочегонное или цитостатическое
лечебное средство. Некоторые из них оказывают также благоприятное воздействие на сердце и сердечно-сосудистую систему.
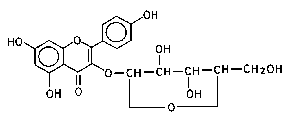 Selenicereus grandiflorus (царица ночи) содержит флавон-гликозиды, такие как например кактицин, грандифлорин, нарциссин и рутин, и возможно также другие действующие на сердце гликозиды и/или сапонины. Ее цветы или побеги оказывают
лекарственный эффект по типу встречающегося у наперстянки (дигиталис), но без кумулятивного влияния, стимулируя сердце, расширяя коронарные и периферические сосуды, возбуждая двигательные нервы спинного мозга и препятствуя воспалительным
процессам. Сок этих дикорастущих растений вызывает кожный зуд и образование прыщей и принятый орально, тошноту, рвоту и понос. В Европе применяется S. grandiflorus, выращиваемый в теплицах, в фармацевтических целях и иногда терапевтически при органических и функциональных сердечных болезнях, в Америке также против катарального цистита,
удушья, водянки и наружно против ревматических недугов. Аналогичное применение находит Eriocereus martinii.
Selenicereus grandiflorus (царица ночи) содержит флавон-гликозиды, такие как например кактицин, грандифлорин, нарциссин и рутин, и возможно также другие действующие на сердце гликозиды и/или сапонины. Ее цветы или побеги оказывают
лекарственный эффект по типу встречающегося у наперстянки (дигиталис), но без кумулятивного влияния, стимулируя сердце, расширяя коронарные и периферические сосуды, возбуждая двигательные нервы спинного мозга и препятствуя воспалительным
процессам. Сок этих дикорастущих растений вызывает кожный зуд и образование прыщей и принятый орально, тошноту, рвоту и понос. В Европе применяется S. grandiflorus, выращиваемый в теплицах, в фармацевтических целях и иногда терапевтически при органических и функциональных сердечных болезнях, в Америке также против катарального цистита,
удушья, водянки и наружно против ревматических недугов. Аналогичное применение находит Eriocereus martinii.

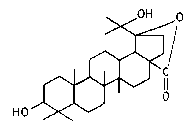 Сапонин обладает высокой токсичностью для существ дышащих через жабры, таких как рыбы и амфибии. Она основывается на том, что эти животные теряют, из-за повышения проницаемости жаберного эпителия, жизненно важные электролиты в окружающую их
воду. Так брошенный в раздавленном виде в воду Machaerocereus eruca, нижнекалифорнийский кактус покрытый кинжаловидными колючками с местным названием «ползучий дьявол», служит туземцам в качестве отравы для рыб по причине содержания в нем сапонина. Добытые рыбы могут быть съедены без вреда для здоровья.
Сапонин обладает высокой токсичностью для существ дышащих через жабры, таких как рыбы и амфибии. Она основывается на том, что эти животные теряют, из-за повышения проницаемости жаберного эпителия, жизненно важные электролиты в окружающую их
воду. Так брошенный в раздавленном виде в воду Machaerocereus eruca, нижнекалифорнийский кактус покрытый кинжаловидными колючками с местным названием «ползучий дьявол», служит туземцам в качестве отравы для рыб по причине содержания в нем сапонина. Добытые рыбы могут быть съедены без вреда для здоровья.
Аглюконы производные тритерпенсапонинов были найдены в следующих видах:
| Lemaireocereus: |
Эритродиол , Керетаровая кислота , Туберогенин, Трелизегенин, и другие |
| Machaerocereus: |
Бетулиновая кислота, Гуммозогенин, Махаэровая кислота, Махаэриновая кислота , Стеллатогенин |
| Myrtillocactus: |
Кошаловая кислота, Чичипегенин, Лонгиспиногенин, Миртиллогеновая кислота, Олеаноловая кислота, Стеллатогенин |
| Rhodocactus: |
Олеаноловая кислота |
Открытый недавно в Pterocereus gaumeri алкалоидный гликозид (или алкалоид-гликозид) птероцереин ещё не изучен фармакологически. В качестве красящих веществ плодов и цветов кактусы содержат бетациан (красный и фиолетовый), бетаксантин (желтый и оранжевый) и также флавонглюкозид (желтый). Так как у кактусов антоцианы вообще отсутствуют, у них не бывает голубых окрасок. Из аглюконов, производных флавонол-глюкозидов, в опытах над животными использовались кверцетин и камфарное масло как возможные канцерогены и мутагены.
Экологическое значение действующих веществ.
К взаимоотношениям между живым организмом и его окружающей средой относится, наряду с обменом потоками энергии и круговоротами веществ, также передача информации. Когда носителями информации являются химические вещества,
они все обозначаются как аллело- химикаты или экомоны (биолины). Алломоны представляют собой экомоны служащие для межвидового общения и преимущественно приспособленные для тех, кто их выделяет, в то время кайромоны также служат для
межвидового общения, но полезны, наоборот, воспринимающему их организму. Эти функции исполняют с большой вероятностью — алкалоиды, гликозиды и другие вторичные природные вещества.
Одной из причин для производства химических защитных веществ (репеллентов) в растении является недостаток физической подвижности, делающий невозможным бегство от неприятелей. В ходе эволюции в качестве защитных механизмов возникают как морфологические (посредством образования шипов и колючек), так и химические (через биосинтез алкалоидов и т. д.) адаптации. Защитные вещества растений действуют при этом как вызывающие раздражение, токсические и/или ухудшающие вкусовые свойства, и они делают растения несъедобными для врага. Так, кактусы с богатым алкалоидным составом обладают неприятным, горьким вкусом. Но не существует связи между околюченностью кактуса и содержанием в нём же репеллентов, т. к. есть не только крупные растительноядные враги, которых нужно отпугивать, но и насекомые, клещи и т. д. Некоторые кактусовые алкалоиды и сапонины подавляют вследствие их фунгицидного (противогрибкового) или антибиотического воздействия рост грибов и
бактерий и защищают растение в качестве суппрессанта от поражения микроорганизмами. При неблагоприятных условиях, например — при так называемой «зимовке» в наших коллекциях, понижается содержание репеллентов и
суппрессантов, и растения могут быть легче поражены вредителями или болезнями.
Выделяют ли кактусы также аллелопатические вещества, которые после распределения и накопления в окружающей почве оказывают тормозящее воздействие на образование всходов и рост других видов растений, еще не ясно. Те, кто
когда-либо пробовали, поселить на какой-нибудь грядке с сильными растениями сеянцы других видов, будут почти склонны увидеть в пищевой конкуренции не единственную причину для их скудного роста или вообще полного увядания.
Также среди кактусов известны примеры влияния аллело-химикатов как кайромонов. Так дрозофила Drosophila pachea прельщается на встречающийся в растении-хозяине Lophocereus schoitii — шоттенол; этот стерин действует также как аттрактант (вещество привлекающее насекомых). Оба равным образом содержащихся алкалоида лофоцереин и пилоцереин развивают с другой стороны эффект как репелленты против других видов дрозофилы и обеспечивают D. pachea этим широкое бесконкурентное жизненное пространство. Однако алкалоид карнегин из «сагуаро» действует как репеллент против D. pachea, в то время как не отпугивающаяся этим D. nigrospiracula может жить на этом растении-хозяине без конкурентов.
Разъяснение экологического значения кактусовых действующих веществ еще только находится на начальной стадии, и некоторые интересные открытия в этой области еще предстоят.
Примечание.
Кактусовым алкалоидам присваивается еще одно известное значение — хемотаксономическое, они могут быть интересны при решении таксономических вопросов об отношении каких-либо видов растений к определённым родам, например при разграничении родов Dolichothele и Mammillaria, или при дифференцировании двух видов как добавочный признак, например как у внешне трудно различимых Lophophora williamsii и L. diffusa. Наряду с таким теоретическим значением знания о кактусовых составляющих веществах обладают, конечно же, и практическим значением. Так по каким-либо причинам очутившийся в пустыне Сонора путешественник, чтобы удалить свой голод и жажду, скорее предпочтет мякоть Ferocactus, чем почти непригодного в пищу «сагуаро». Не удивительно, что туземцы, особенно в отдаленных от цивилизации полупустынях, пользуются кактусами и другими суккулентами как лечебными средствами. Еще 100 лет тому назад лекарства местной флоры у наших предков пользовались существенно более высоким уважением, чем сейчас. Но не исключено что, то или иное растительное лекарство на основе новых научных достижений снова будет интересно
для современной медицины.
Но ни в коем случае эти строки не должны склонить к тому, чтобы с помощью питомцев вашей коллекции начать лечить всевозможные свои или чужие физические недостатки. И самые робкие, которые сейчас неуверенны, должны ли они расстаться с тем или иным видом из-за его токсичности или взять растения под замок, могут быть спокойны, т. к. еще 450 лет тому назад Парацельс писал: «...всё вокруг ядовито, и нет ничего без яда. И только доза может сделать вещество неядовитым».
Literatur:
BEHRINGER, K.: Der Meskalinrausch, seine Geschichte und Erscheinungsweise.
Springer, Berlin. 1927
BRIGGS, J. R.: «Muscale buttons» - Physiological action - A Mexican fruit
with possible medicinal virtues. Druggists' Bulletin 1 (5): 78 1887
BRUHN, J. G.; BRUHN, C.: Alkaloids and ethnobotany of Mexican peyote cacti and related species.
Econ. Bot. 27:241 -251.1973
BRUHN, J. G.; HOLMSTEDT, B.: Early peyote research - An interdisciplinary study. Econ.
Bot. 28 :353-390.1974
BRUHN, J. G.: LINDGREN. J.-E.; HOLMSTEDT, B.; ADOVASIO, J. M.: Peyote alkaloids -
Identification in a prehistoric specimen of Lophophora from Coahuila. Mexico.
Science 199 :1437- 1438. 1978
DOMINGUEZ, X. A.; ROJAZ, P.; GUTIERREZ, M.; ARMENTA. N.: DE LARA, G.; Preliminary
Chemical study of thirthy-one cacti. Rev. Soc. Quim. Mex. 13 (1): 8A-12A. 1969
HEFFTER, A.: Uber Cacteenalkaloide (2. Mitteilung) Ber. ehem. Ges. 29:216-227.1896
HEGNAUER, R.: Chemotaxonomie der Pflanzen III: 324-337. Birkhauser, Basel. 1964.
HUXLEY, A.: The doors of perception. Charta & Windus, London. 1954
KAPADIA, G. J.; FAYEZ, M. B. E.: Peyote constituents - Chemistry, biogenesis, and
biological effects. J. pharmaceut. Sei. 59 : 1699-1727.1970
LEWIN, L.: Uber Anhalonium lewinii. Arch. exp. Pathol. Pharmacol. 24:401-411.1888
MATA, R.; McLAUGHLIN, J. L.: Cactus alkaloids. 45. Tetrahydroquinolines from the Mexican
cereoid Pachycereus pringlei. Planta med. 38:180-182.1980
MATA, R.; McLAUGHLIN, J. L.: Cactus alkaloids. 50. A. comprehensive tabular summary.
Rev. Latinoamer. Quim. 12 : 95-117. 1982
MEYER, B. N.; MOHAMED, Y. A. H.; McLAUGHLIN, J. L: -Phenethylamines from the cactus
genus Opuntia. Phytochemistry 19: 719-720.1980
MICHAUX, H.: L'lnfini turbulant. Meroure de France, Paris. 1957
PARDANANI, J. H.; McLAUGHLIN, J. L.: Cactus alkaloids. 36. Mescaline and related compounds
from Trichocereus peruvianus. Lloydia 40:585-590. 1977
PAUL, A. G : Biosynthesis of the peyote alkaloids. Lloydia 36 :36-45. 1973
ROSENBERG, H.; PAUL, A. G.: Dolichothelin, a novel imidazole alkaloid from Dolichothele
sphaerica. Tetrahedron Leiters 13 : 1039-1042.1969.
SCHLEE, D.: Zur okologischen Bedeutung sekundarer Naturstoffe - Beispiel: Alkaloide.
Biol. Rdsch 20 :17-32.1982
STROMBOM, J.; BRUHN, J. G.: Alkaloids of Pachycereus pecten-aboriginum, a Mexican
cactus of ethnopharmacologic interest. Acta pharmaceut. Suecica 15:127-132.1978
Др. Х. Сварт, исследовательский институт химической
токсикологии Академии наук ГДР.
KuaS 1983 (34), №8, стр. 173-175.
Перевод Аллы Блиновой, 2002.
Читать больше по этой теме на нашем сайте:
об алкалоидах —
о гликозидах —
о растительных ядах |